Legame covalente polare
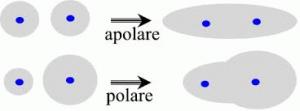
Quando gli elettroni vengono condivisi da atomi del medesimo elemento, ciascun atomo li attrae con la medesima intensità. In questo caso gli elettroni condivisi (elettroni di legame) possono essere immaginati come una nuvola negativa che si dipone in maniera omogenea e simmetrica intorno ai due nuclei senza produrre alcun tipo di polarità sulla molecola. Si parla in questo caso di legame covalente puro.
Nella maggior parte dei casi però gli atomi che formano il legame covalente appartengono ad elementi diversi che presentano una diversa forza di attrazione sugli elettroni di legame.
Si definisce elettronegatività χ (chi) la forza con cui un atomo attira a sé gli elettroni condivisi. I valori di elettronegatività si trovano tabulati nella tabella periodica e presentano il valore minimo in basso a sinistra (Francio = 0.7) e crescono diagonalmente fino ad assumere il valore massimo in alto a destra (Fluoro = 4) In genere si usa la scala di elettronegatività di Pauling.
Dunque, quando si forma un legame covalente tra due atomi che presentano diversa elettronegatività la nube elettronica che costituisce il legame covalente risulta spostata verso l'atomo più elettronegativo. Quest'ultimo acquista pertanto una carica parzialmente negativa (indicata con d-), mentre l'altro una carica parzialmente positiva (d+).La distribuzione asimmetrica della nuvola elettronica produce dunque due poli aventi carica opposta (dipòlo) ed il legame viene perciò definito covalente polare.
E’ ciò che accade, ad esempio nella molecola dell’acido Cloridrico (HCl) in cui l’Idrogeno condivide un elettrone con il Cloro. Il Cloro più elettronegativo presenta una parziale carica negativa e la molecola di HCl risulta polare
Maggiore è la differenza di elettronegatività (Δχ) tra i due elementi e maggiore sarà la polarità del legame (le cariche parziali saranno più vicine ad una intera carica).
Quando la differenza di elettronegatività tra i due elementi supera il valore critico di 1.9, si assume che l’elemento più elettronegativo sia in grado di strappare l’elettrone all’altro elemento ed il legame viene descritto come ionico.
Possiamo dunque descrivere il legame ionico come un caso limite del legame covalente polare per Δχ > 1.9
Prendiamo ora in considerazione la molecola dell'acqua H2O
Ciascun atomo di Idrogeno condivide il suo elettrone con uno dei due elettroni condivisi dall'Ossigeno
Si formano due legami covalenti. Ma le nuvole elettroniche ad essi associate vengono in questo caso attirate con maggior forza dal nucleo dell'ossigeno (più elettronegativo), il quale contiene ben 8 protoni contro il solo protone che costituisce ciascun nucleo di Idrogeno.
Ancora una volta possiamo rappresentarci la situazione immaginando che la nuvola elettronica negativa sia deformata, più densa sopra l'elemento più elettronegativo.
La carica che si forma alle estremità o poli della molecola sarebbe intera e non parziale solo se la differenza di elettronegatività tra i due elementi fosse talmente elevata da permettere all'elemento più elettronegativo di strappare l'elettrone di legame. In tal caso si formerebbero però due ioni ed il legame non verrebbe descritto più come covalente, ma come ionico.
Tutte le sostanze chimiche che al loro interno presentano dei dipoli si dicono polari, le altre apolari.
La presenza di un dipolo sulle molecole d’acqua può essere facilmente rilevata osservando che un sottile filo d'acqua che scende da un rubinetto viene deviato dalla verticale se gli viene avvicinato un bastoncino di plastica o vetro caricato elettricamente per strofinio.